《京津冀药物临床试验机构日常监督检查标准》正式发布

各有关单位:
为贯彻落实国务院办公厅《关于全面加强药品监管能力建设的实施意见》有关工作部署,完善药物临床试验监管领域标准体系建设,推动京津冀药物临床试验监管协同发展,促进监管能力持续提升,服务医药产业高质量发展,现就做好药物临床试验领域监管工作通知如下:
一、统一监督检查标准,逐步构建三地药物临床试验监管领域协同发展监管标准体系
三地药品监管部门联合制定《京津冀药物临床试验机构日常监督检查标准》(附件,以下简称检查标准),建立药品监管领域三地首个统一的区域性检查标准,合力推动京津冀药物临床试验机构质量管理水平的整体提升,促进京津冀三地药品监管优势互补、互利共赢、协同发展,发挥区域性合作示范效应。
二、加强监管能力建设,持续提升检查员队伍及从业人员业务能力水平
结合检查标准的出台,三地药品监管部门应加强对检查员、机构从业人员的培训与宣贯,提升检查员队伍监管能力,发挥检查标准对临床试验运行管理的监督、指导作用,为新药研发提供有力质量保障与支撑。
三、强化区域协作,探索三地监管协作新模式
京津冀首次统一实施区域性的日常监督检查标准,在标准执行过程中难免会遇到一些问题,应探索三地药物临床试验机构日常监管工作协作新模式,加强三地监管工作交流,及时就标准执行过程中的有关问题进行沟通、研究;同时,在检查员培养、临床试验数据核查、服务产业发展等方面加强相互协作,促进区域协同发展。
四、严格质量管理,强化机构主体责任
各药物临床试验机构应严格落实主体责任,强化内部质量管理,以检查标准为指导,加强自查自纠,确保依法依规开展药物临床试验。各级药品监管部门应严格执行检查标准,统一监管尺度,做好风险管控,强化闭环管理,依法查处违法行为。同时,还应从服务创新、促进发展的高度出发,监管中应加强对机构的指导,引导机构切实发挥主体责任,规范试验项目运行及质量管理,以高质量的管理促进产业高质量的发展。
《京津冀药物临床试验机构日常监督检查标准》自本通知发布之日起施行。《北京市食品药品监督管理局关于印发<北京市药物临床试验机构日常监督检查标准(试行)>的通知》(京食药监药注〔2014〕19号)、《市药监局关于发布<天津市药物临床试验机构监督检查要点>的通知》(津药监药注〔2019〕20号)和《河北省药品监督管理局关于印发<河北省药物临床试验机构日常监督检查标准(试行)>的通知》(冀药监药化函〔2019〕579号)同时废止。
附件:京津冀药物临床试验机构日常监督检查标准
北京市药品监督管理局
天津市药品监督管理局
河北省药品监督管理局
2021年7月19日
附件
京津冀药物临床试验机构日常监督检查标准
总 则
一、为加强京津冀药物临床试验机构监督管理,提升药物临床试验质量管理水平,根据《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》《药品注册管理办法》《药物临床试验质量管理规范》《药物临床试验机构管理规定》《涉及人的生物医学研究伦理审查办法》《药物临床试验伦理审查工作指导原则》等规定,制定本检查标准。
二、本检查标准适用于京津冀行政区域内药物临床试验机构的日常监督检查,包括备案后的首次监督检查。
三、检查标准分为药物临床试验组织管理机构、伦理委员会、专业三个部分,包括30个检查环节、133个检查项目。其中关键项目18项(标示为“★”),一般项目115项,包含对备案条件、机构运行管理、项目实施等方面的检查内容。
四、检查中发现不符合要求的项目统称为“缺陷项目”。其中,关键项目不符合要求者称为“严重缺陷”,一般项目不符合要求者称为“一般缺陷”。
五、检查结果评定
检查结果按药物临床试验组织管理机构、伦理委员会、专业三个检查部分分别评定。
(一)各检查部分均未发现缺陷项目,检查结论为符合要求。
(二)发现缺陷项目,但各检查部分均未发现严重缺陷,且一般缺陷数量占相应检查部分一般项目总数量的比例≤20%,检查结论为基本符合要求。机构对发现的问题应立即组织整改,并于10个工作日内将整改情况报告报送所在地省级药品监管部门或其指定的监管部门,整改期间机构可继续承接药物临床试验。如仅涉及对备案条件的检查,检查项目可不包括A4.6、A5.2-A5.4、A6.2-A6.3、A8.2-A8.4、B4.3-B4.4、B5、B6.1、B6.3、B7.2、C5、C7-C15,计算缺陷项目比例时,上述检查项目不纳入项目总数(下同)。
(三)发现任何严重缺陷,或药物临床试验组织管理机构、伦理委员会、专业任何一部分,发现一般缺陷数量占相应检查部分一般项目总数量的比例>20%的,检查结论为不符合要求。机构对发现的问题应立即组织整改。涉及机构或伦理委员会不符合要求的,整改期间该机构不得开展新的药物临床试验项目;涉及专业(包括Ⅰ期临床试验研究室)不符合要求的,整改期间相关专业不得开展新的药物临床试验项目。整改完毕后应向所在地省级药品监管部门或其指定的监管部门提交整改报告及跟踪检查申请,现场检查符合要求后,方可开展新的药物临床试验。隐瞒真实情况、提供虚假信息或者采取其他欺骗手段取得备案的,以及整改期间开展新的药物临床试验的,由所在地省级药品监管部门提请国家药监局取消该机构或专业备案。涉及违法行为的,依法查处,并向所在地省级卫生健康主管部门通报。
根据工作需要对部分检查项目进行抽查时,检查结果判定仍按上述要求实施。
A.药物临床试验组织管理机构检查项目
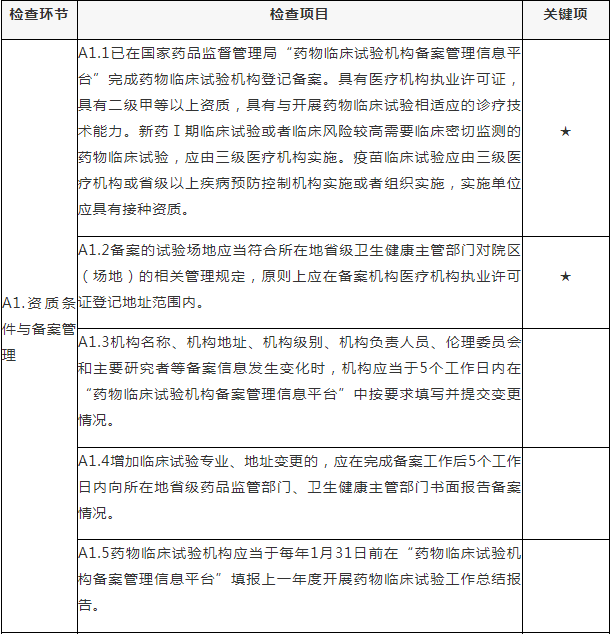
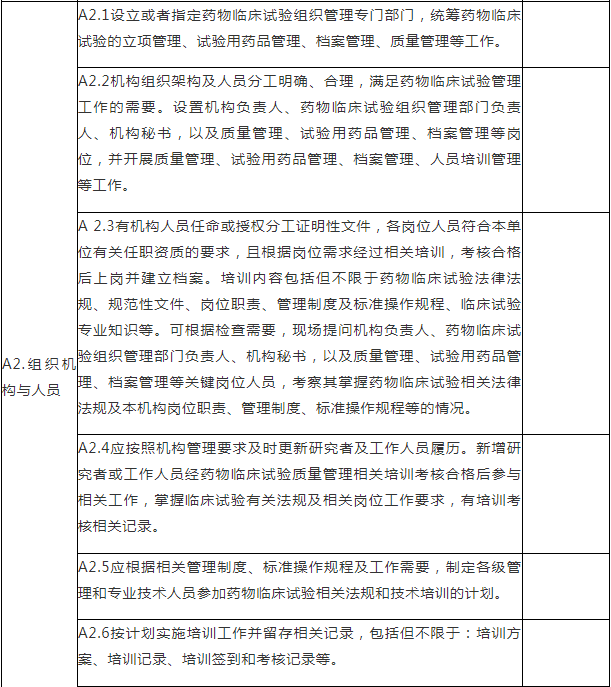


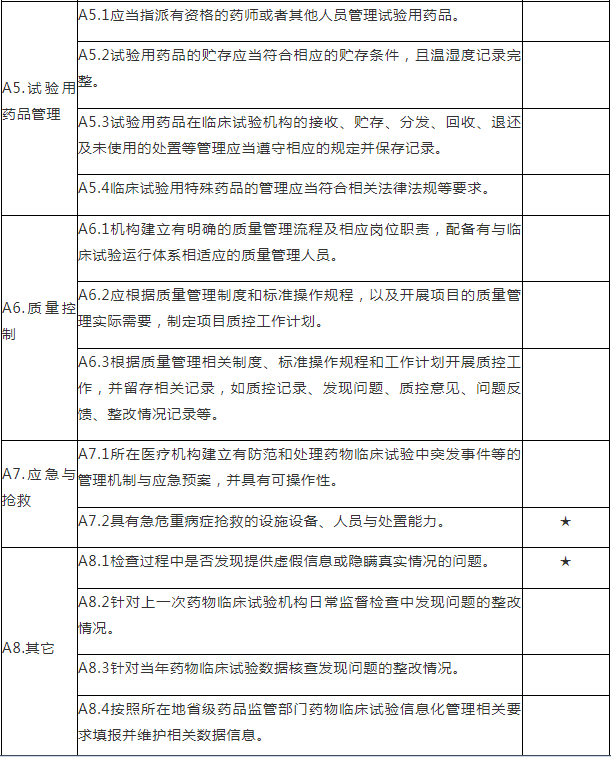
注:A.药物临床试验组织管理机构检查项目包括8个检查环节、34个检查项目,其中关键项目4项,一般项目30项。如仅涉及对备案条件的检查,检查内容包括25个检查项目(不涉及A4.6、A5.2-A5.4、A6.2-A6.3、A8.2-A8.4),其中关键项目4项,一般项目21项。
B.伦理委员会检查项目

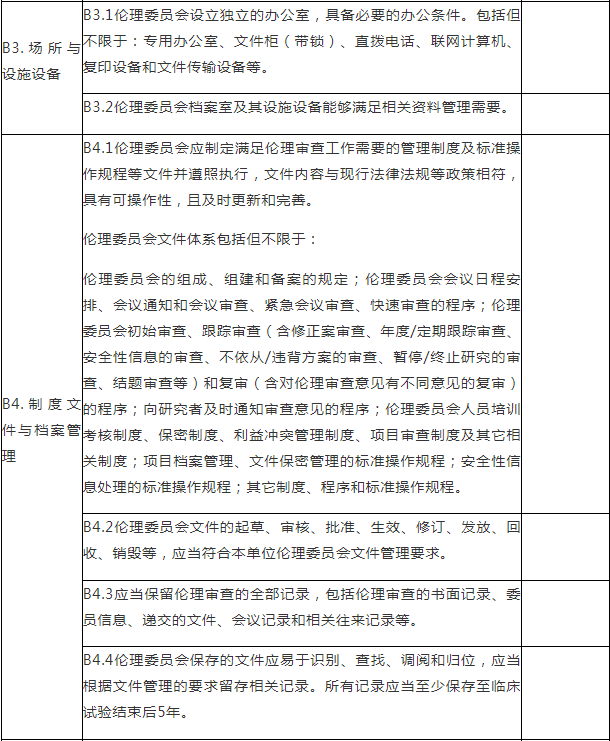


注:B.伦理委员会检查项目包括7个检查环节、31个检查项目,其中关键项目4项,一般项目27项。如仅涉及对备案条件的检查,检查内容包括15个检查项目(不涉及B4.3-B4.4、B5、B6.1、B6.3、B7.2),其中关键项目4项,一般项目11项。
C.专业检查项目
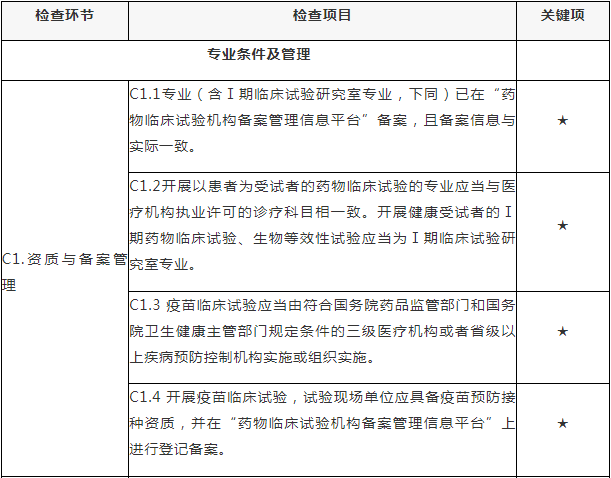





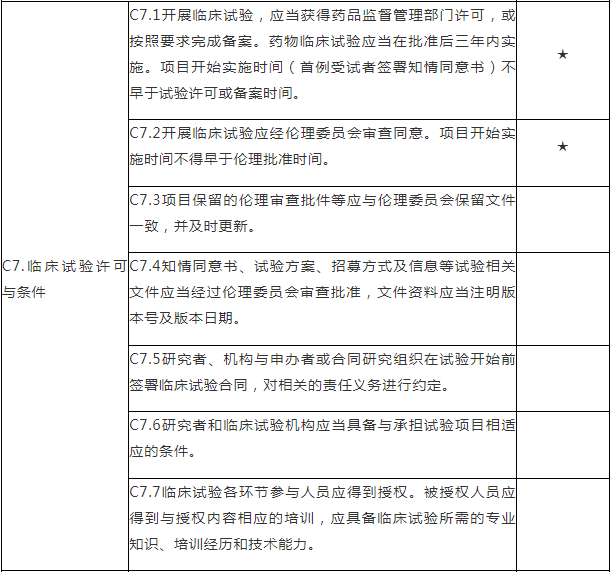


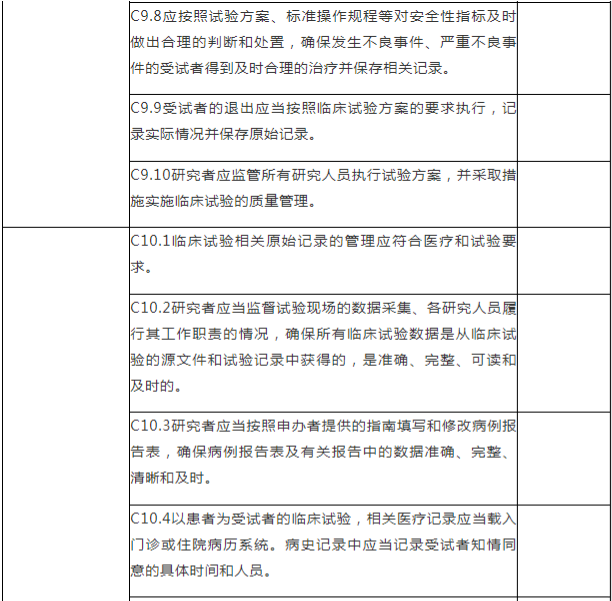

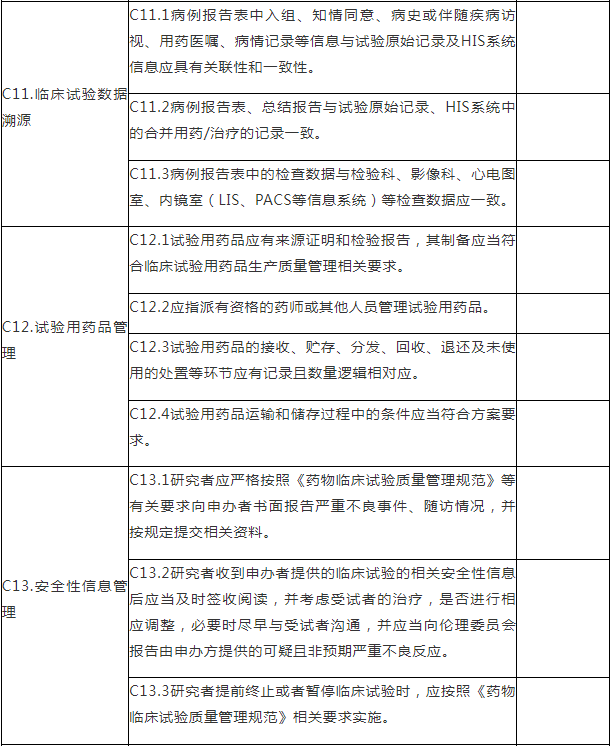

注:C.专业检查项目包括15个检查环节、68个检查项目,其中关键项目10项,一般项目58项。如仅涉及对备案条件的检查,检查内容包括20个检查项目(不涉及C5、C7-C15),其中关键项目7项,一般项目13项。