专题培训丨药物浓度-QTC临床研究
药物浓度-QTC临床研究专题

办会单位
主办单位:山东省药学会临床研究质量与风险管理专业委员会
协办单位:临床研究能力提升与参与者保护实践平台(CCHRPP)
承办单位:北大医疗鲁中医院

培训对象及相关信息
各医药企业、CRO、临床研究机构及参与临床试验的相关人员。
本专题会议为线下现场培训,2025年8月22日报道,8月23日全天会议。
培训地点:山东省淄博市临淄区淄博万豪大酒店万豪厅。

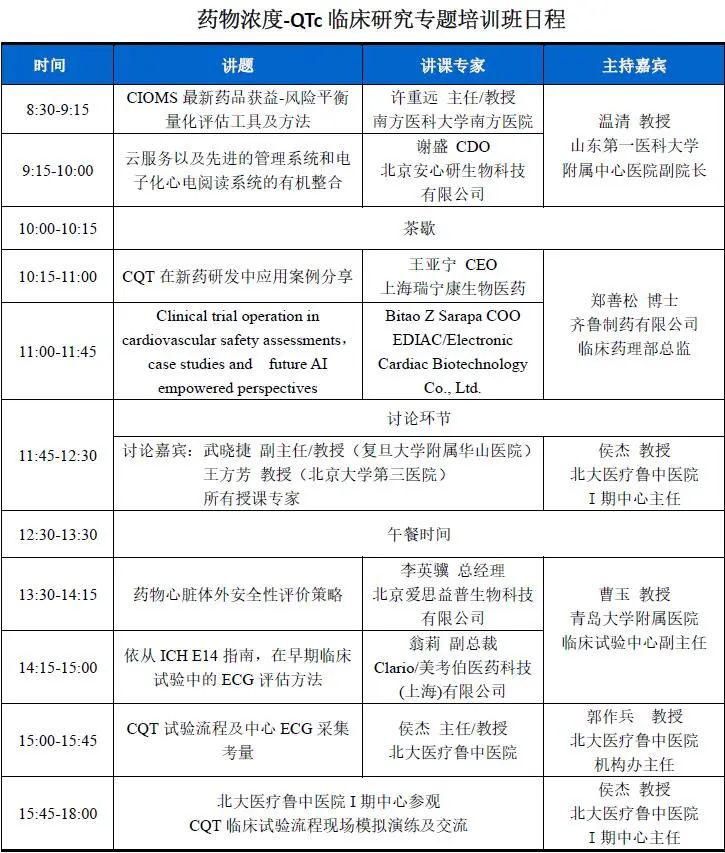
培训日程

讲者嘉宾介绍
许重远
· 主任药师/教授
医学/工学 双博士,主任药师/教授,南方医科大学南方医院药物临床试验中心主任兼Ⅰ期临床研究室主任、南方医科大学国家药监局药物代谢研究与评价重点实验室副主任;南方医科大学药学院教授、研究生导师,中国药科大学客座教授;曾为美国范德堡大学临床与转化研究中心访问学者和美国希望之城医学中心访问教授。
中国药学会药物临床评价研究专委会主任委员;
中国药学会常务理事、战略发展专家委员会成员;
全国“互联网医疗健康产业联盟”数字临床研究专委会主任
临床研究能力提升与参与者保护实践平台( CCHRPP )发起人;粤港澳 I 期&BE临床研究共享联合平台牵头人。从事早期临床试验研究及临床药物代谢动力学/药效学等工作;主持1.1 类新药I 期临床试验105项。获得国家及省部级课题10余项。先后获得军队、省级科技进步奖5项;获得专利30余项,软著2项;主编专著4部;主编全国规划教材1部;发表论文80余篇。获得中国药学会“最美科技工作者”称号;获得18届中国药学发展奖突出成就奖.
谢盛
· 首席开发官&首席数据官(CDO)
首席开发官&首席数据官(CDO)
北京安心研生物科技有限公司
曾任职global临床研究公司,负责开发和运行该global CRO的临床项目管理分析软件系统,具有二十年行业经验。
开发完成的Global公司心电图中心阅读分析系统,已经完成了数百项目的阅读分析,并获得行业认可。
负责开发安心研公司的三大系统:安心传、安心云、安心阅。
王亚宁
· 上海瑞宁康生物医药创始人兼CEO
博士,现任上海瑞宁康生物医药创始人兼CEO,为新药研发,出海,审评上市提供咨询服务。
2021年9月至2024年5月任朗来科技CEO,期间带领团队推进近十个新药研发项目至不同临床阶段,在资本寒冬期完成5亿元A轮融资,并将多个项目成功出海,达成高额交易。
2021年之前担任美国FDA临床定量药理审评部部长,负责所有疾病领域的定量药理学审评,研究项目和政策制定。该部门是FDA唯一覆盖所有疾病领域的审评部。
他于2003年加入FDA之前在佛罗里达大学获得药学博士和统计学硕士双学位。1999年获得生物化学硕士学位,1996年获得北京大学药学学士。发表了120余篇论文,在各种国内和国际会议上发表500多次报告。目前担任北京大学,佛罗里达大学,上海中医药大学和中南大学湘雅药学院客座教授。2023年荣获美国华盛顿特区健康领域杰出领导人称号。王博士作为监管专家和资深顾问为中国药监局,中国科技部,上海自贸区基金,上海药学会药物临床研究专委会,以及多家华尔街投资机构和银行提供新药研发和上市咨询。
赵碧涛
·Bitao Z Sarapa COO
Bitao Z Sarapa
COO
EDIAC/ElectronicCardiac Biotechnology Co., Ltd.
拥有二十余年欧美、澳大利亚、中国、东南亚、拉丁美洲和中东地区开展全球I-IV期临床试验的经验。
近十年,专注心脏安全评价和TQT及CQT临床试验,具有丰富II-III期全球多中心临床研究心脏安全评价及心电图监测临床运营管理经验。
擅长新药发现、临床前开发到全阶段临床试验及医学事务对接。
熟悉与NCI、NIH等各大研究机构和大学合作,熟悉临床KOL和主要研究者(PI)。
李英骥
· 北京爱思益普生物科技有限公司总经理
博士,北京爱思益普生物科技有限公司总经理。
2004年获得吉林大学理学博士学位,2006年获得德国吉森大学(Justus-Liebig University of Giessen)心血管医学博士学位。在心血管系统和中枢神经系统新药研发以及药物心脏安全性评价具有丰富的经验。2010年回国创立北京爱思益普生物科技股份有限公司,致力于靶点驱动的药物发现生物学一体化平台,专注肿瘤、免疫、代谢、心血管、中枢神经系统等疾病领域的体外生物学及体内药理学研究技术。爱思益普批量构建了新药筛选的靶点和筛选技术及早期成药性评价平台,致力于以高效、专业的服务,帮助新药研发企业快速有效地推进新药研发项目。
翁莉
· Onglee Weng ,Clario Shanghai 总经理
Onglee Weng ,Clario Shanghai 总经理
20+ 年新药研发行业工作经验,10年海外工作经验
中国注册临床医师
携团队成功完成中国和日本的首例合规要求的TQT试验
携团队为多家国家级领先的I期临床中心完成TQT试验法规和实操培训,并共同完成数项研究性课题在国际期刊发表
参与中国CDE邀请的ICH E14 & S7B 中文翻译及其技术指导原则制定的专家组工作
负责管理Clario 在中国市场的医学影像业务和心血管安全业务
侯杰
· 北大医疗鲁中医院I期临床研究中心主任/PI
MD. Ph.D,教授、博士生导师
CDE审评专家、CFDI专家
北大医疗鲁中医院I期临床研究中心主任/PI
1989年开始在北京医科⼤学临床药理研究所从事新药临床研究。2002年作为博⼠后 赴美从事心血管临床药理研究, 参与数十项心脏安全评价。
2013年完成国内首个符合 ICH E14 的TQT临床试验, 至今完成数十项CQT及TQT研究,其中中美双报近十项。
至今负责完成两百多项Ⅰ-II 期新药临床试验,其中数十项创新药物的首次⼈体试验,二十余项生物类似药及五十余项生物等效性试验,
2009年后曾参与NMPA多个指导原则的起草,包括“药物Ⅰ期临床试验管理指导原则”、“药物临床试验⽣物样本分析实验室管理规定”,2011年12月颁布。2024年修订后颁布征求意见稿。
2023年参与起草《 创新药C-QT 临床研究技术指导原则 》(征求意见稿),2024年10月发布征求意见稿。
武晓捷
· 复旦大学附属华山医院临床药理研究中心副主任
博士,华山医院临床药理研究中心副主任
复旦大学附属华山医院临床药理研究中心副主任
副研究员,博士,硕士研究生导师
主要从事创新药早期临床研究和临床药理学研究,参与临床试验160余项,作为主要研究者或合作主要研究者承担临床试验40余项。
浙江大学临床医学本科,英国阿伯丁大学临床药理学硕士,复旦大学传染病学博士。丹麦皇家医院访问学者,哈佛大学医学院临床研究学者培训毕业
曾借调至NMPA药品审评中心、科技部人类遗传资源管理办公室工作,曾任NMPA药品审评中心统临部兼职审评员
任中国药理学会定量药理学专业委员会委员、中国药理学会化疗药理专业委员会委员、药物临床试验技术创新联盟早期临床/BE研究专业委员会副秘书长、中国药理学会药物临床试验专委会青委副主委、中国医药教育协会肿瘤临床研究培训基地副主委、中国药理学会代谢专委会青委会委员、上海市医学会感染与化疗专委会委员、上海市药学会老年药学专委会委员、上海市药学会药物临床研究专委会委员、上海市药理学会药物代谢专委会委员、上海市药理学会临床药物评价专委会委员
王方芳
· 北京大学第三医院心内科主任医师
北京大学第三医院心内科主任医师,副教授,硕士生导师,药物临床试验机构I期研究病房负责人
2009年北京大学医学部临床医学博士毕业,北京大学第三医院心血管内科工作至今,2017年获国家留学基金委资助赴美国密歇根大学心脏中心学习。
2020年担任药物临床试验机构I期研究病房负责人,承担心血管代谢性疾病创新药物I期临床研究20余项,参与I期临床研究30余项。
曾获得:北京大学青年岗位能手,北医三院优秀青年医师,北医三院优秀教师,中国医师协会青年科研人才“未来之星”。
学术任职:北京肿瘤学会临床研究专业委员会副主任委员;中国医药质量管理协会“临床研究质量与评价”专委会常委;中国医师协会心血管内科医师分会代谢学组委员;冠心病介入诊断与治疗北京医学会心血管病分会心血管病交叉学组委员;CCI杂志中文版编委;国家自然科学基金青年评审专家;
发表SCI收录论文20余篇,获国家自然科学基金及首都卫生发展科研专项基金资助。

主持嘉宾介绍
温清
· 山东第一医科大学附属中心医院 副院长
主任药师 ,二级教授
山东第一医科大学附属中心医院 副院长
山东第一医科大学临床药学院 副院长
享受国务院特殊津贴专家
国家药品监督管理(NMPA)新药审评/核查专家
山东省医药卫生重点学科(临床药学) 学科带头人
济南市临床药理重点实验室负责人
泉城产业领军人才
中国医药教育协会药物临床试验研究与评价分会 副主委
山东省医学会药物临床研究与评价分会 主委
美国亚利桑那大学与Frontage lab临床研究中心访问学者
主要从事新药早期临床研究,主持国家新药创制重大专项-临床研究平台建设,作为项目负责人(PI)完成药物临床试验260余项。
曹玉
· 青岛大学附属医院临床试验中心副主任
博士,主任药师,博士生导师
青岛大学附属医院临床试验中心副主任,办公室主任,I期临床研究中心主任
青岛大学分子医学与新药研究院副院长
中国药学会药物临床评价研究专业委员会副主任委员;中国药理学会药物临床试验专业委员会常务委员;中国食品药品企业质量安全促进会临床研究管理专业委员会副主任委员;山东省药学会临床研究质量与风险管理专委会主任委员
主持BE/I期临床试验项目100余项
负责国家科技重大专项GCP平台课题2项,发表SCI论文30余篇
郑善松
· 齐鲁制药临床研发中心临床药理总监
博士,正高级工程师,齐鲁制药临床研发中心临床药理总监
主要从事新药成药性评价、临床药理和定量药理研究工作,作为临床前或临床药理负责人完成15个新药、生物类似药和改良新药的上市申请;主持重大新药创制等省部级课题4项;申请发明专利33项,获得国内外授权16项。
中国抗癌协会肿瘤临床药学专业委员会委员、中国药理学会药物代谢专业委员会青年委员,中国药促会脑神经药物临床专业委员会委员和中国医药教育协会肿瘤临床研究培训基地委员。
山东省泰山产业领军人才,泉城产业领军人才。
郭作兵
· 北大医疗鲁中医院药物临床试验机构办公室主任
北大医疗鲁中医院药物临床试验机构办公室主任,主任药师
主持完成了医院Ⅰ期研究病房建设和国家药物临床试验机构资格认定、备案等工作。参与180余项Ⅰ期至Ⅲ期临床试验的方案审查、试验流程的运行管理及质量控制。作为主要研究者承接早期临床试验10余项。主持完成临床试验相关的省重点研发计划项目1项。
山东省药学会药物临床评价研究专业委员会副主任委员
山东省药学会药物临床研究质量与风险管理委员会副主任委员
山东省药学会药物临床研究与评价青年专业委员会副主任委员
淄博市医学会药物临床研究与评价专业委员会主任委员

报名相关
本次培训收取注册费1000元/人(山东省药学会会员900元/人),培训结束并考核合格者,由山东省药学会颁发培训证书。请扫描“缴费二维码”缴费,缴费→听课→考试合格后方可领取培训证书。培训证书为电子版,由会务组核对后发至预留邮箱。
建议团体缴费方式:由单位或科室集体扫码缴费,备注单位和参会人,交款人相关详细信息可发邮箱
zbgcpxh@126.com
缴费二维码(请填写参会人姓名):

本次培训往返交通费及食宿自理,会务提供8月23日中午自助餐。

会议酒店住宿
淄博万豪大酒店
地址:山东省淄博市临淄区临淄大道782号;
住宿协议价:
5-6楼的高级标间和单间268元/间;
豪华标间协议价格298元/间;豪华单间协议价格328元/间。
酒店联系人:孙经理 13969302020
住宿请提前联系酒店预订房间。

会务组联系方式
石志磊 18553376859
顾弘炜 18553355512
郭作兵 18553376257