联系方式
伦理审查及受理流程
1、药物临床试验审查受理流程
(1)送审流程
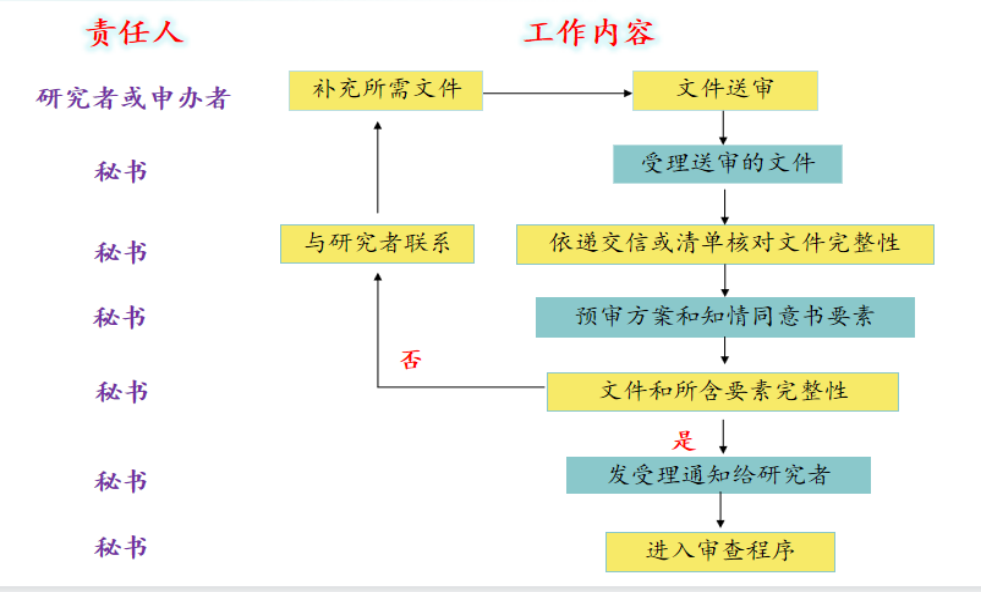
(2)审查流程

2、医疗器械临床试验审查受理流程
(1)送审流程

(2)审查流程

伦理递交资料清单及附件
1.药物临床试验递交清单及附件:
1
递交信(含所递交文件清单,注明所有递交文件的版本号或日期);
2
伦理初审审查申请表(药物/医疗器械)(见附件一)(申请者签名并签署日期)
3
临床试验方案摘要
4
临床试验方案(注明版本号和日期)
5
病例报告表(注明版本号和日期)
6
知情同意书(注明版本号和日期)
7
研究者手册(注明版本号和日期)
8
研究者履历
9
招募受试者材料
10
临床试验受试者日记卡和其他问卷表
11
1)国家药品监督管理局《药物临床试验批件》部分Ⅳ期可不要求
2)按照《国家药品监督管理局关于调整药物临床试验审评审批程序的公告》(2018年7月30日)的要求,不再使用临床批件,而是以“自申请受理并缴费之日起60日内,申请人未收到国家食品药品监督管理总局药品审评中心否定或者质疑意见的,可按照提交的方案开展药物临床试验”,且伦理批件前置。
12
试验药物的合格检验报告
13
所有以前其他伦理委员会或管理部门对申请研究项目的重要决定的说明,应提供以前否定结论的理由
14
申办者资质(三证)、委托书和CRO资质文件(如有)
15
其他资料(如受试者须知、受试者日记、紧急联系卡、试验样本使用管理声明或出境批文、保险等)。
2.医疗器械临床试验递交清单及附件:
1
递交信(含所递交文件清单,注明所有递交文件的版本号或日期);
2
伦理初审审查申请表(药物/医疗器械)(见附件一)(申请者签名并签署日期)
3
临床试验方案摘要
4
临床试验方案(注明版本号和日期)
5
临床试验病历报告表(注明版本号和日期),受试者日记卡和其他问卷表
6
医疗器械说明书
7
注册产品标准或相应的国家、行业标准
8
产品质量检测报告
9
医疗器械动物实验报告(如有)
10
研究者手册(注明版本号和日期)
11
研究者履历
12
招募受试者材料
13
知情同意书(注明版本号和日期)
14
所有以前其他伦理委员会或管理部门对申请研究项目的重要决定
15
申办者资质、委托书和CRO资质文件(如有)
