浏览量:1793+
机构传真:
机构邮箱:
接待时间:
每周一至周五:上午8:00-11:30,下午15:00-17:00
所在地址:
伦理电话
0391-2759787
伦理传真
0391-2759787
伦理邮箱
jzeyllwyh@163.com
接待时间
周一至周五(8:00-11:30,15:00-17:00)
伦理网址
http://www.jzeyy.com/
所在省市
河南焦作
详细地址
联系方式
伦理召开的时间
按照项目安排伦理时间
伦理召开频率
原则上每月一次,视项目受理情况和相关事宜进行调整。
伦理上会形式
会议审查
伦理审查费用
上会3000元(不含税),快审1000(不含税)
相关政策
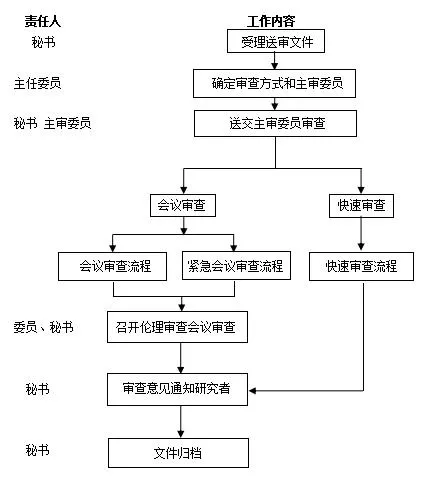
伦理审查及受理流程
伦理递交资料清单及附件
1、II/Ⅲ/Ⅳ期临床研究伦理审查申请文件清单
1 | 伦理初审审查申请表(药物/医疗器械) |
2 | 临床试验受理函及回执单 |
3 | 临床试验方案摘要 |
4 | 临床试验方案(注明版本号和日期) |
5 | 病例报告表(注明版本号和日期) |
6 | 知情同意书(注明版本号和日期) |
7 | 研究者手册(注明版本号和日期) |
8 | 研究者履历 |
9 | 招募受试者材料 |
10 | 临床试验受试者日记卡和其他问卷表 |
11 | 国家药品监督管理局《药物临床试验批件》部分Ⅳ期可不要求 |
12 | 试验药物的合格检验报告 |
13 | 所有以前其他伦理委员会或管理部门对申请研究项目的重要决定的说明,应提供以前否定结论的理由 |
14 | 申办者资质(三证)、委托书和CRO资质文件(如有) |
15 | 其他资料(如受试者须知、受试者日记、紧急联系卡、试验样本使用管理声明或出境批文、保险等)。 |
所有文件提交纸质版一份(盖章),同时提交电子版。 | |
2、医疗器械临床试验伦理审查申请文件清单
1 | 伦理初审审查申请表(药物/医疗器械) |
2 | 临床试验受理函及回执单 |
3 | 临床试验方案摘要 |
4 | 临床试验方案 |
5 | 临床试验病例报告表,受试者日记卡和其他问卷表 |
6 | 医疗器械说明书 |
7 | 注册产品标准或相应的国家、行业标准 |
8 | 产品质量检测报告 |
9 | 医疗器械动物实验报告(如有) |
10 | 研究者履历 |
11 | 招募受试者材料 |
12 | 知情同意书 |
13 | 所有以前其他伦理委员会或管理部门对申请研究项目的重要决定 |
14 | 申办者资质(三证)、委托书和CRO资质文件(如有) |
所有文件提交纸质版一份(盖章),同时提交电子版。 | |